突破防线强队友
细胞穿膜肽(CPPs)是抗肿瘤肽中突破敌人防线的强队友,它能穿透肿瘤细胞,并可以递送如小分子化合物、蛋白、核酸等货物到达细胞内。然而它常常不能很好的瞄准肿瘤细胞,因此需要肿瘤靶向肽(TPP)的帮助。
细胞穿膜肽(cell-penetrating peptide,CPPs)是指一类能够穿透肿瘤细胞的肽段,一般少于30个氨基酸,其中碱性氨基酸占多数,大多富含精氨酸和赖氨酸、带正电荷,pH 接近中性。CPPs作为优良的药物递送载体广受关注。CPPs递送的货物可以从小分子(<1kDA)到大微粒,并能与货物(Cargo)偶联,或以能允许药物、载体,脂质体细胞递送的方式相互作用。它与纳米颗粒、蛋白、核酸等需进入胞内发挥活性的抗肿瘤药物以共价或非共价形式连接,通过跨膜转导或细胞胞吞作用等方式运载货物到达胞内。
HIV-TAT肽是最早发现的CPPs,另有其他如penetratin(Antp),transportan及其变体TP10等也被广泛研究。他们共同的特点是均含阳离子残基,某些情况下可被疏水残基分离形成两亲性螺旋结构。穿膜能力等同于疏水性,一些CPPs具有强疏水性,如PFDYLI肽。
对于大多数治疗用CPPs(如Tat或R8)的主要挑战是肿瘤细胞特异性的缺乏,因此需要进行修饰,或与肿瘤特异性配体融合使CPPs有肿瘤组织归巢能力,以获得最佳抗癌效力。最近的研究利用了肿瘤微环境的独特生理学,例如酸性环境,以产生对癌细胞具有更高特异性的新型CPPs。
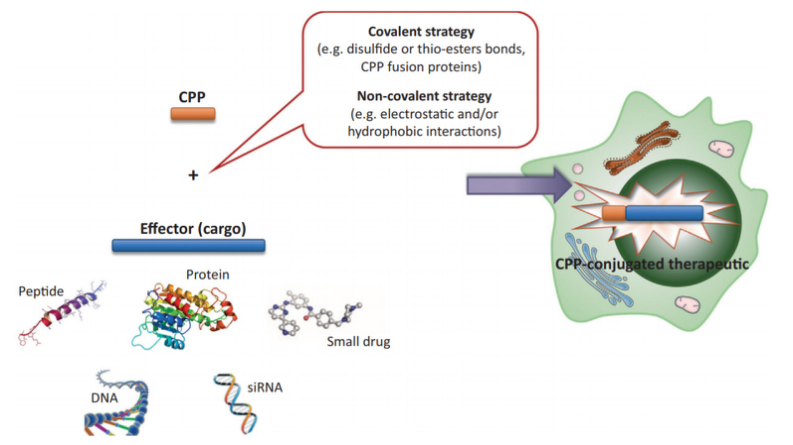
图1.CPPs递送货物的种类和方式 [2]
根据CPPs有无靶向性,将其分成非靶向穿膜肽(以TAT为代表)和靶向穿膜肽(以iRGD为代表):
(1) 非靶向穿透肽:TAT蛋白转导肽是HIV-1编码的一段富含碱性氨基酸、带正电荷的多肽,属于蛋白转导域家族的一员。其全长序列及11个碱性氨基酸富集区的核心肽段(YGRKKRRQRRR)不仅能够在包括蛋白质、多肽及核酸等多种外源生物大分子的跨膜转导过程中起到重要作用,而且能够携带这些外源生物大分子穿透活体细胞的各种生物膜性结构(细胞膜和血脑屏障等)进入胞内并发挥生理功能,但其跨膜转导机制仍不十分明确。它具有穿透细胞的功能,但缺少肿瘤靶向性。
(2) 靶向肽与穿透肽偶联:如果有些药物与靶向肽偶联合以后并没有达到预想的抗肿瘤效果,可能原因是其内化效率较低。为了克服上述偶联物的不足,将肿瘤靶向肽和穿透肽通过柔性氨基酸相连,形成靶向穿透双功能肽如GRD-Tat、PEGA-pVEC、 gHo-pVEC等。将肿瘤靶向肽(TTP)和穿透肽(CPPs)偶联,可以实现靶向性和穿透性的双重功能;以这些肽作为载体形成的偶联物特异性地将DNA、基因、化疗药物带入肿瘤细胞内,从而达消灭肿瘤细胞的目的。
(3) 靶向穿透肽:肿瘤血管生成过程中血管内皮细胞选择性地大量表达整合素受体,含RGD序列肽段可以与肿瘤血管内皮细胞上的αvβ3受体结合。目前已经有研究表明,经RGD靶向肽修饰的纳米载体可将药物、siRNA、造影剂等投递到肿瘤血管处。然而,肿瘤血管靶向只是将药物载体聚集于肿瘤血管内及其附近的组织,药物载体如何跨血管壁,并有效地穿透到实体肿瘤仍然是目前肿瘤靶向治疗的主要障碍。
氨基酸C-端序列为R/KXXR/K的短肽是肿瘤组织内广泛高表达的神经纤毛蛋白-1(NRP-1)受体的特异性配体。“氨基酸C-端序列为R/KXXR/K”的位点效应为C-端法则(CendR)。CendR序列和NRP-1的相互作用是药物克服生理屏障,促使其在组织内穿透的最关键因素。例如,血管内皮生长-165 (VEGF-165)的C-末端序列为R/K/XXR/K,因而其符合CenddR法则,VEGF-165与NRP-1受体结合,促进了其血管穿透性。经研究,在既含肿瘤靶向血管肽RGD又符合CendR渗透法则的序列中,CRGDK/RGPDC环肽与肿瘤细胞的亲和性最高,并能有效扩散入肿瘤组织和肿瘤细胞内,他们称这种双重功能的短肽为“iRGD”,或称肿瘤穿透肽。
确定CPPs及其递送货物如何进入细胞,如何逃脱胞内体或溶酶体到达细胞质(或细胞核)仍然是一项技术难题。由于实验观察或CPPs序列的微小变化即会对生物学结果产生深远影响,情况变得复杂。此外,CPPs的有效细胞外剂量范围可以超过10μM,这表明胞吞递送(和逃逸)可能导致低效率的胞质积累。
虽然CPPs穿膜机制仍存在很大争议。且已提出很多跨膜机制,主要包括三类 [3]:
(1) 第一类是通过静电作用直接渗透进入细胞膜。具体过程为未折叠的CPPs首先与细胞膜表面通过静电方式结合,直接跨过细胞膜,接着在分子伴侣的帮助下发生重折叠;
(2) 第二种跨膜机制是通过形成某种跨膜结构发生转导进入细胞。这类机制包括三种可能的模式:反转微团模式、地毯模式和打孔模式;
(3) 第三种跨膜机制是胞吞作用介导入膜,这类机制是在发现CPPs跨膜过程中涉及胞吞作用后提出的。
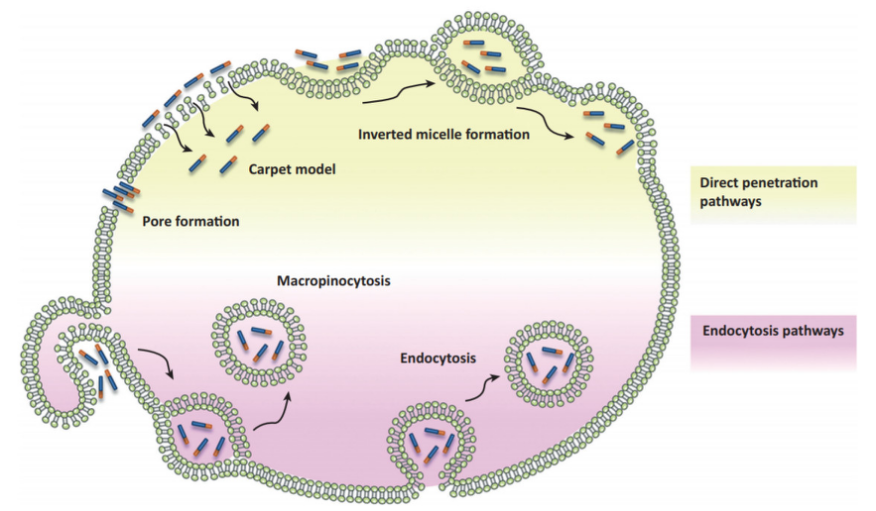
图2.CPPs作用机制 [2]
(1) 直接穿膜
现已提出的直接穿膜机制包括:反转微团模式(inverted micelle model)、地毯模式(Carpet Model)、打孔模式(barrel-stave pore model)。所有这些模式,均需要阳离子型CPPs先与细胞质膜上的磷脂双分子层等阴离子成分相互作用,导致质膜的稳定性改变,而随后的内在化过程则依赖于CPPs的类型和浓度、货物的特性、所处理的细胞系以及孵育条件等。这些机制虽能够解释CPPs跨膜转运的某些方面,但均不能提供适用于所有类型CPPs的一个完整的内化途径。
反转微团模式:是应用核磁共振(NMR)研究penetratin与磷脂膜相互作用时提出来的。这种机制的核心内容是阳离子型CPPs首先与磷脂膜上阴离子相互作用,接着在CPPs的疏水性氨基酸残基和磷脂膜的相互作用下磷脂双分子层发生重排和穿梭运动,随后CPPs被包埋进入反转微团中,微团移动到脂双层膜的另一侧,直接将CPPs释放到胞浆中。由于这种模式假设在翻转微团形成过程中,需要CPPs中疏水氨基酸残基的参与,因此对于TAT和寡聚精氨酸这类不含疏水性氨基酸残基的CPPs来说,这类机制并不适用。
打孔模式:也称为木桶板模式,是抗菌肽进入细菌的一种内化机制。孔型通道的形成需要两亲型CPPs的α-螺旋结构的参与。CPPs成束聚集排列于细胞表面并平行排列插入细胞膜中,形成桶样结构的通道,其螺旋的疏水区域结合到膜脂中形成孔道的外表面,而亲水部分则与磷脂亲水头部结合,形成孔道的中心内腔,从而介导CPPs发生跨膜转位,实现内化。
地毯模式:被用来描述一些抗菌肽的转位机制,但也用来描述高浓度CPPs的细胞毒性。在这种模式中,阳离子型CPPs像地毯一样覆盖在负电荷质膜表面,随后由于CPPs中碱性氨基酸残基朝向质膜表面,疏水性氨基酸残基与质膜的疏水性核心相互作用,当CPPs的浓度达到阈值时,就会局部破坏磷脂膜,使得CPPs进入细胞。
(2) 胞吞途径
胞吞途径是否参与CPPs的穿膜,一直是CPPs穿膜机制研究的焦点。尽管一些情况下,CPPs通过直接跨膜的方式穿过细胞膜,但普遍认为大多数的CPPs及其装载的货物是通过胞吞作用进入细胞的。当CPPs携带货物以胞吞的方式进入细胞,被转运的货物可能不被CPPs释放而转移至溶酶体中被降解掉,而在CPPs与货物复合体被运送到溶酶体降解之前,其命运取决于其逃脱核内体小室的能力。胞吞作用具体可以分为四种类型:网格蛋白介导的包吞作用、小窝蛋白/脂筏介导的胞吞作用、网格蛋白/小窝蛋白非依赖性的胞吞作用和大胞饮作用。
特定CPPs的胞吞途径,不仅依赖于其自身的特性,还依赖于其结合货物的类型、大小、电荷或者疏水性。例如,当TAT和蛋白结合时,通过脂筏介导的胞吞作用进入细胞,而当其与荧光基团结合时,则通过网格蛋白介导的胞吞作用进入细胞。当CPPs结合大分子货物时(MW > 30 kD),则通过大胞饮的形式进入细胞,其中大胞饮为肌动蛋白依赖性的胞吞途径,具有膜波动和囊泡形成特性,不同于其他类型的胞吞作用。
(已完结)
