糖尿病多重受体激动剂未来新星—Tirzepatide
糖尿病多重受体激动剂未来新星—Tirzepatide
Tirzepatide(以下简称TZP) 或 LY3298176 是Lilly研发管线中的GLP-1和GIP双重受体激动剂,用于治疗II型糖尿病,可能有治疗肥胖和NASH的潜力,目前处于III期临床。
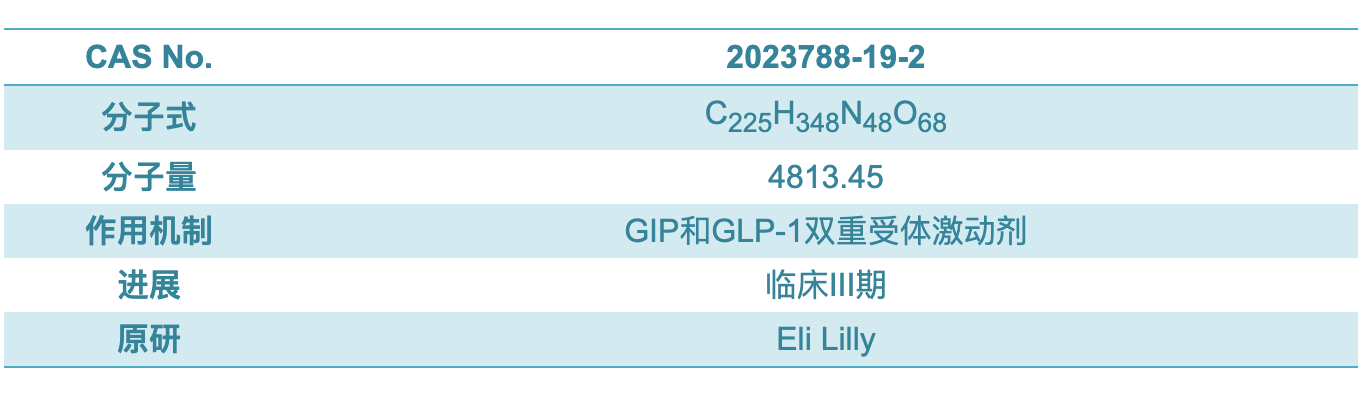
TZP是含有39个氨基酸的线形肽,在第20位的赖氨酸残基通过一个接头与一个C20脂肪二酸模块缀合,第2和第13位包含两个非编码氨基酸残基(Aib,α-氨基异丁酸),C末端被酰胺化。酰化技术可实现白蛋白结合[1]。与Lilly度拉鲁肽的长效化通过Fc融合蛋白实现不同,TZP的结构为GIP部分肽序的类似物和艾塞那肽部分肽序的拼合,并缀合类似索马鲁肽侧链的脂肪酸链达到长效化的作用 [2]。TZP的侧链与索玛鲁肽侧链相似:由一个脂肪酸链和AEEA链连接组成,侧链主要功能是提高半衰期,实现长效化一周注射一次。
图1.GLP-1 VS. TZP VS. 已上市的GLP-1受体激动剂结构对比 [2]
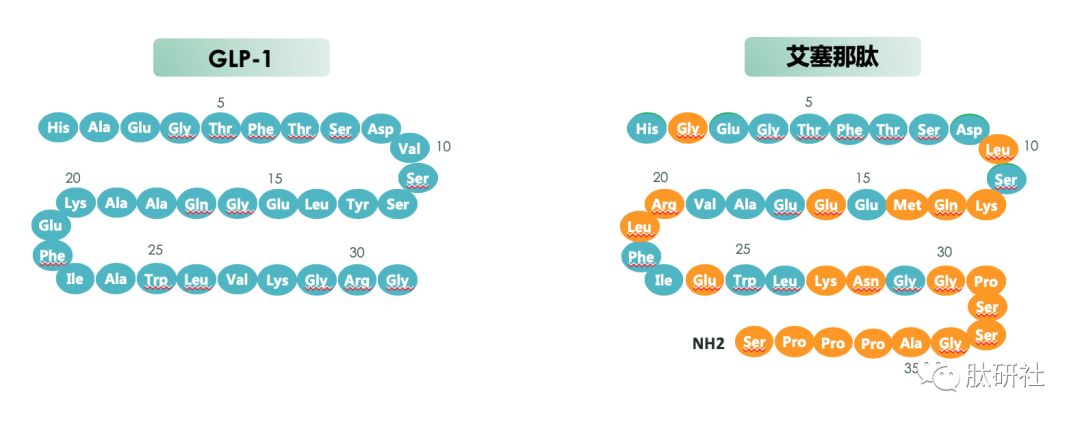
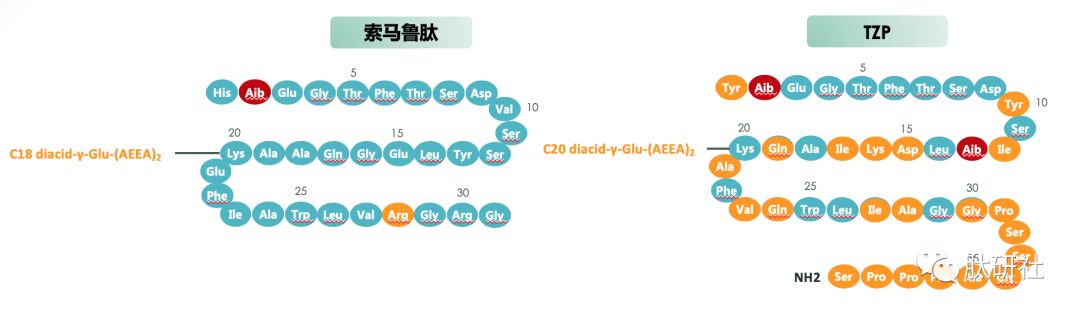
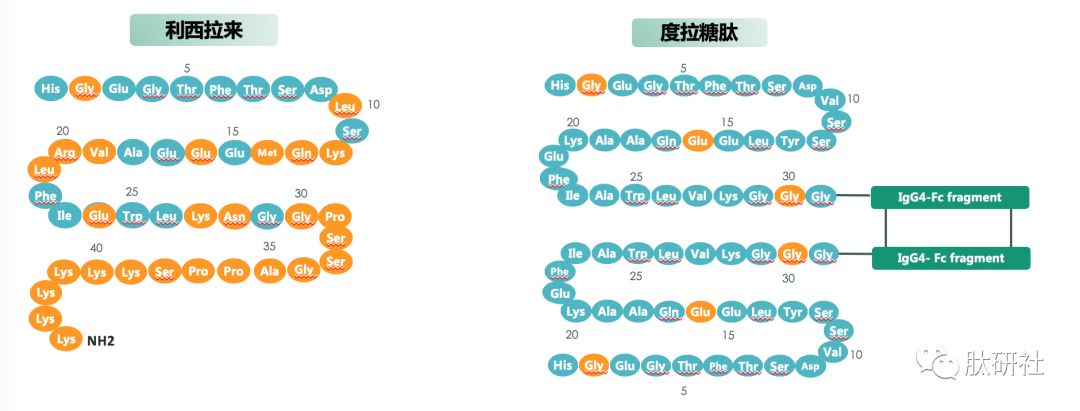
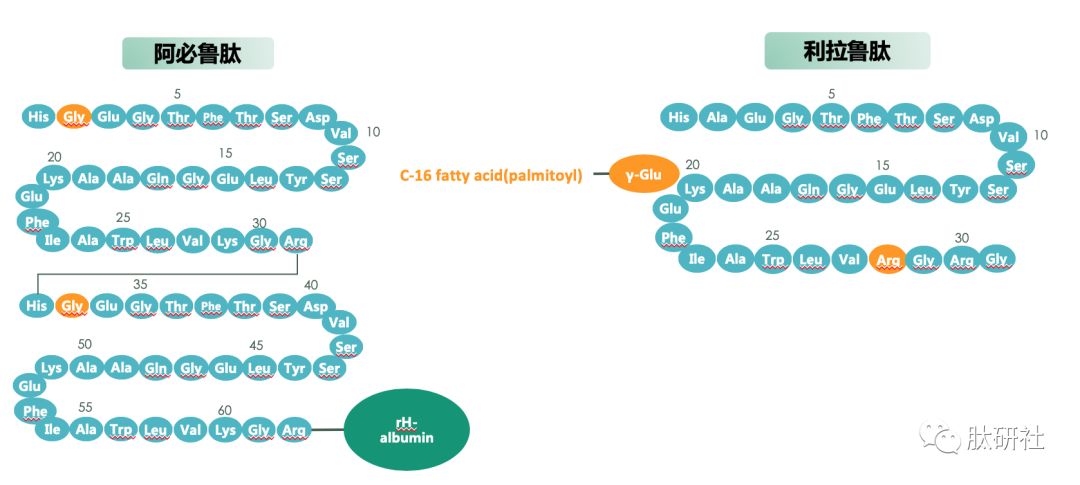
酰化技术使白蛋白结合成为可能,以实现每周一次人体给药的方案。
表1.TZP的药代动力学 [1]
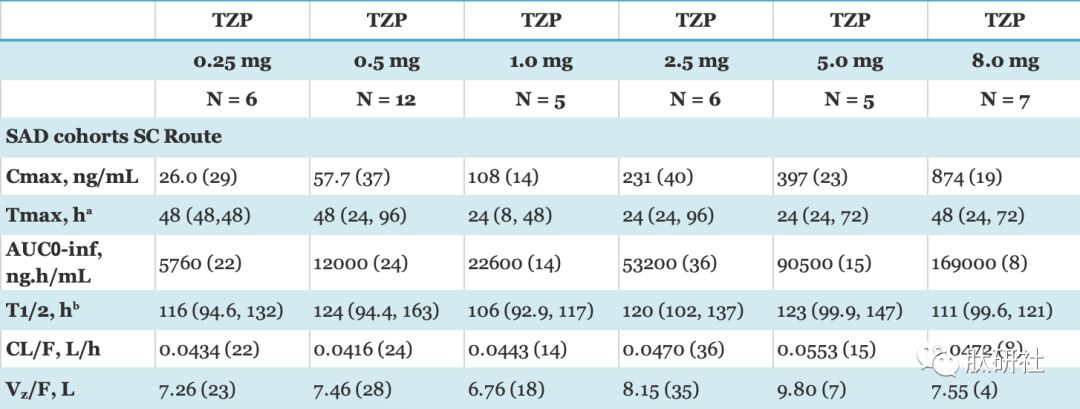
Data are Geometric Mean (coefficient of variability CV %), unless otherwise noted. aMedian (minimum, maximum), bGeometric mean (minimum, maximum), Abbreviations: SAD = single ascending dose, Cmax = maximum observed drug concentration, Tmax = time of Cmax, AUC0-inf = area under the concentration time curve from time 0 extrapolate to infinity, CL/F = apparent total body clearance of drug following subcutaneous administration, Vz/F = apparent volume of distribution of drug during terminal phase following subcutaneous administration, N = number of subjects, T1/2 = half-life associated with the terminal rate constant in non-compartmental analysis.
TZP被EvaluatePharma评为2020年最具价值的R&D项目,NPV为 $11.72Bn,并预测2024年的营收为$1.6Bn [3][4]。作为GLP-1和GIP双重受体激动剂,TZP有望成为治疗糖尿病和肥胖症的新一代疗法。在接下来的两天,肽研社将对TZP的临床进展做进一步介绍,并展望基于GLP-1的多重受体激动剂研究。
基于Tamber Coskun[1],Juan Pablo Frias [2] [3]的研究对临床试验进行报导。通过研究TZP的临床方案,我们发现该分子虽然在降血糖、减重方面有显著效果,但给药剂量大,有胃肠道副反应。欲获得文献全文,请在后台回复“TZP临床试验”。
TZP针对II型糖尿病(T2D)的III期临床Surpass正在进行,预计临床将在2021年结束,2022年提交注册。同时,Lilly计划开展肥胖的III期临床,NASH的II期临床以拓展适应症。中国已于2020-3-13日获批临床,临床试验登记号为CTR20191601。
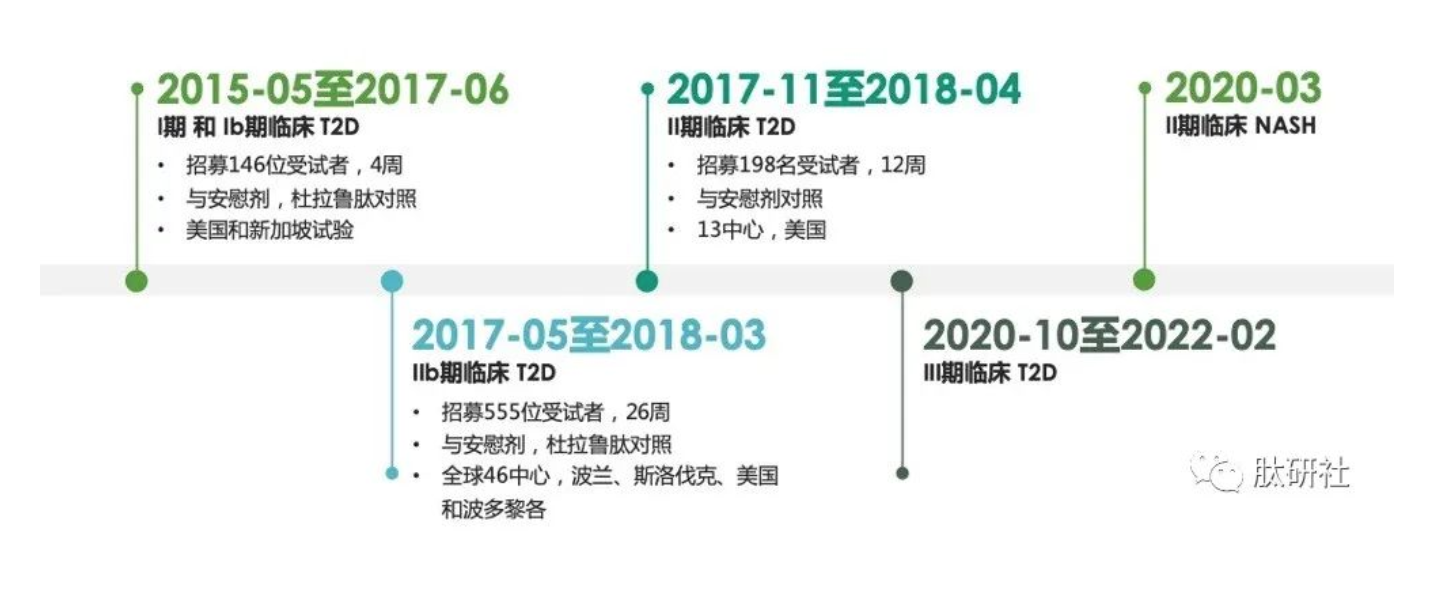
图1.TZP的临床进展
TZP当前的临床研究结果主要有如下五点 [5]:
1) β细胞功能标志物(胰腺细胞如何产生、储存和释放胰岛素)和胰岛素敏感性(机体细胞如何对胰岛素作出反应)的改善有助于解释功效——提高胰腺β细胞功能,提高患者的胰岛素敏感性;
2) 在初始剂量较低和随后剂量上升较小的情况下,疗效和耐受性得到改善;
3) 在日本人群中,仅仅治疗8周后,T2D患者的糖化血红蛋白HbA1c和体重即表现出显著降低;
4) 在T2D患者中,非酒精性脂肪性肝炎的标志物(NASH,肝脏炎症和肝脂肪所致的细胞损伤)表现出改善;
5) 胃肠道副作用主要为恶心、呕吐和腹泻,为轻度至中度。
1. I期临床 [1]:健康人与T2D患者的安全性与耐受性研究 & 药代与药效动力学研究
2016-05-11至2017-06-26,Lilly在美国和新加坡开展了随机、安慰剂对照,双盲I期临床试验,该试验共招募146位受试者(4位受试者在接受研究药物之前停药)。研究表明TZP在血糖控制和体重方面具有改善潜力,值得进一步临床评估在T2D和肥胖症的应用。

表1.I期临床试验方案
2. II期临床
1) IIb临床 [2]:剂量效应关系 & 与杜拉鲁肽头对头研究
IIb期临床研究以剂量效应关系研究,以及头对头研究为主。该研究为期26周,每周给药一次,TZP含1mg + 5mg + 10mg + 15mg 4个剂量组,杜拉鲁肽1.5mg剂量组,和安慰剂。
主要结果:糖化血红蛋白A1c(HbA1c)与基线相比的平均变化:TZP 1mg为-1.06%,5mg为-1.73%,10mg为-1.89%,15mg为-1.94%;杜拉鲁肽为1.21%,而安慰剂为-0.06%。15mg剂量组有77%的患者HbA1c水平低于7%,10mg剂量组有90%的患者达到控制指标,而杜拉鲁肽组和安慰剂组只有55%和12%的患者达标。TZP的2个高剂量组绝对HbA1c水平下降2.4%、2.0%,高于杜拉鲁肽组的1.2%[6]。
次要结果:平均体重变化:TZP为-0.9kg至-11.3 kg;杜拉鲁肽为-2.7kg,而安慰剂为-0.4kg。
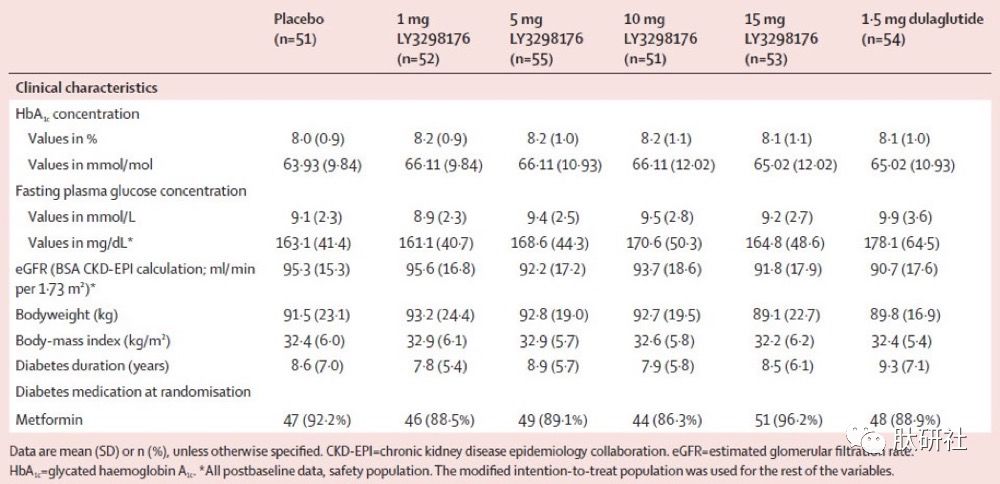
表2.TZP IIb临床特征
不良反应:TZP 1mg为50%,5mg为72.7%,10mg为78.4%,15mg为84.9%;杜拉鲁肽为74.1%,而安慰剂为52.9%。
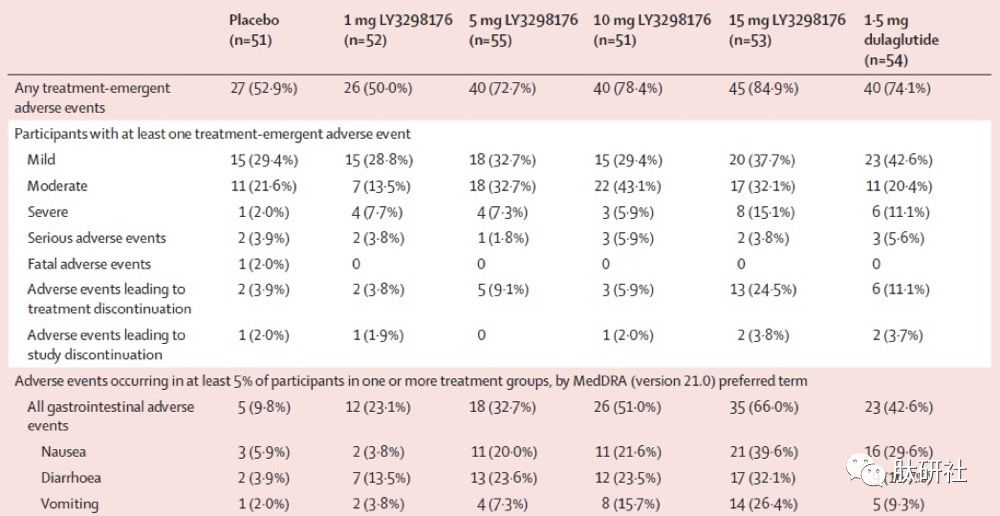
表3.TZP IIb临床不良反应
2) II期临床 [3]:剂量递增的有效性和耐受性研究
为了确定用于III期临床的最佳剂量,II期临床评估了3种剂量递增方案:
a). 12mg剂量组:4mg/周,给药4周 + 8mg/周,给药4周 + 12mg/周,给药4周;
b). 15mg剂量组1:2.5mg/周,给药2周 + 5mg/周,给药2周 + 8mg/周,给药4周 + 12mg/周,给药4周;
c). 15mg剂量组2:2.5mg/周,给药4周 + 7.5mg/周,给药4周 + 15mg/周,给药4周。
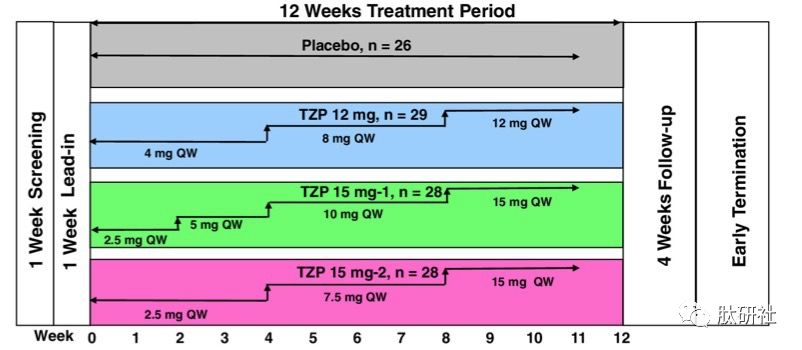
图2.为期12周的剂量递增方案
备注:QW表示一周给药一次
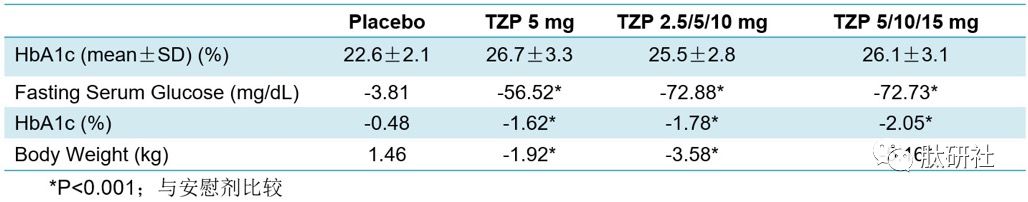
研究结果显示,较低的初始剂量和较小的增量剂量递增可提高耐受性,胃肠道副作用减少,同时保持了IIb期研究中的疗效——IIb期研究相一致,TZP治疗使HbA1c显著降低(高达2.0%)和体重减轻(高达5.7kg)。由此,为III期临床Surpass的给药方案提供了信息。
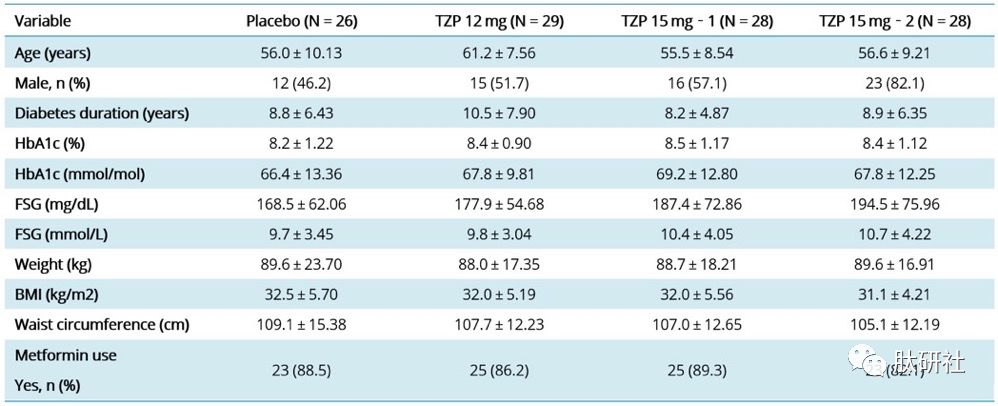
表4.TZP II期临床特征
胃肠道副作用轻至中度,总体低于IIb期。TZP因不良事件导致的治疗中断率低于5%,与安慰剂具有可比性,且总体低于IIb期。不良事件引起的治疗中止率低于5%,与安慰剂相当,总体低于IIb期研究。
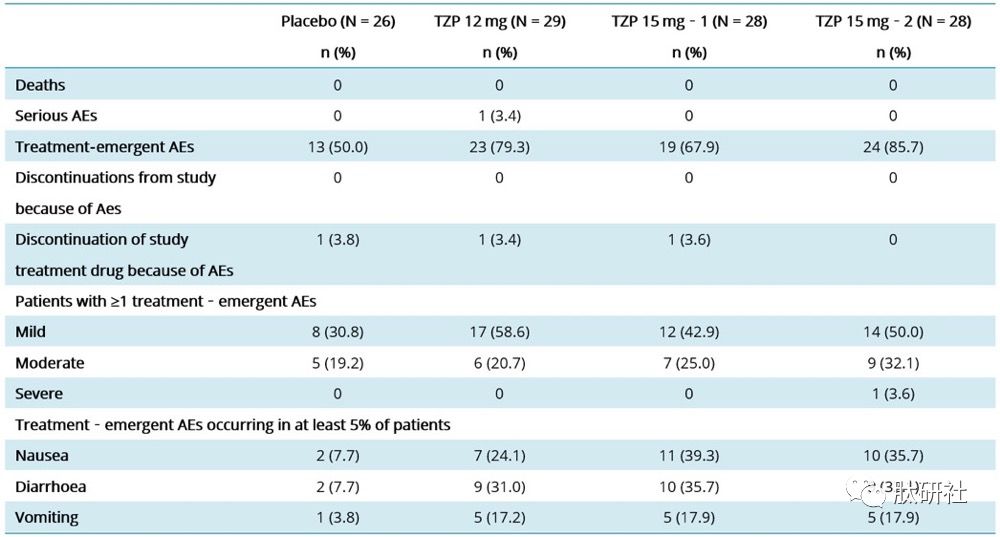
表5.TZP II期临床不良事件
3) 日本II期临床 [8]:无种族差异
以安慰剂为对照、8周多剂量递增、共48名患者参与的研究显示:TZP显著降低了HbA1c(高达2.05%)和体重(高达5.1千克);所有 TZP 剂量均具有可接受的耐受性。不良事件为食欲减退和胃肠道不良事件(恶心、呕吐和腹泻),均为轻度,且为一过性。
这项研究提示TZP有效治疗T2D患者的潜力在各个人群中具有一致性,即其在日本T2D人群中的安全性、耐受性、药代动力和药效学特征与与西方T2D人群类似,并无种族差异。数据支持TZP在日本及其他亚洲国家如中国的T2D患者中使用相同给药剂量及给药方案的III期临床开发。
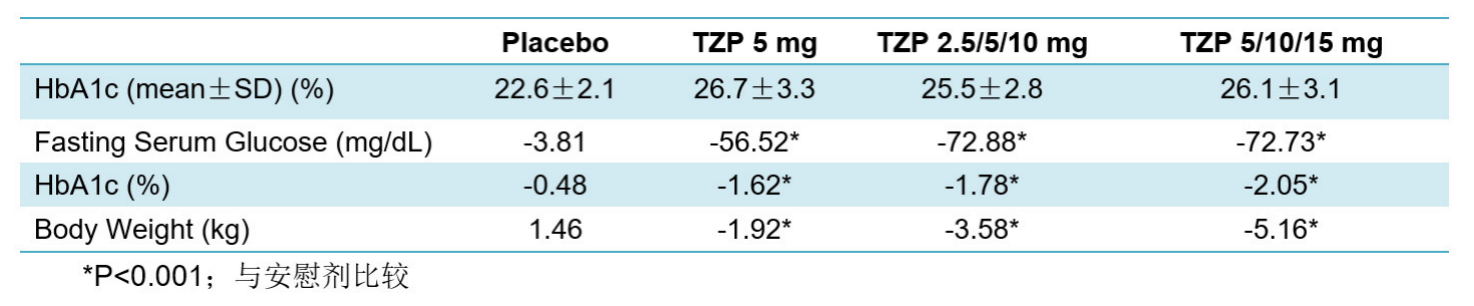
表6.TZP在日本患者中的关键结果
4) IIb和II期临床疗效和胃肠道副作用对比 [7]
较低的初始剂量和较小的增量剂量递增可提高耐受性,胃肠道副作用减少,但减重效果相对较不明显。胃肠道副反应导致令人担忧的退出率,Lilly相信可以通过剂量递增来解决这些问题,但有较长的磨合期(5mg的测试为4周,10mg为12周,15mg测试长达20周),这可能会对该分子的吸引力产生影响。
3. III期临床【9】
除T2D,Lilly正在拓展肥胖和NASH两个适应症的临床。
另外,Lilly计划于2020年开展一项独立的12.5k名患者的心血管事件试验(CVOT),并头对头对照杜拉鲁肽,该行动主要为了弥补杜拉鲁肽在2027年丧失专利保护带来的风险。
4. 临床费用测算【4】【9】
根据EvaluatePharma Vision的预测,除去TZP Surpass-CVOT的费用,该分子完成临床试验的总费用预计为$0.77Bn。而TZP Surpass-CVOT的费用将超过杜拉鲁肽——Trulicity CVOT试验(Rewind)的记录。
Surpass-CVOT将招募T2D和确诊的动脉粥样硬化性心血管疾病的患者。主要终点将是首次出现CV死亡,心肌梗塞或中风这一复合终点的时间,并将评估TZP相对于杜拉鲁肽的非劣效性和优越性。Lilly估计,该研究将需要四年完成。
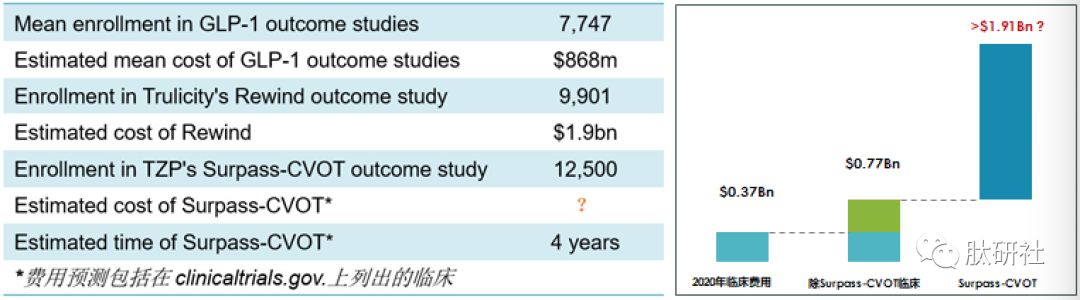
表9.GLP-1试验费用测算
(完结)
上一篇:没有了!
